Üks olulisi küsimusi termodünaamiliste süsteemide uurimisel füüsikas on küsimus, kas see süsteem suudab teha kasulikku tööd. Töö mõistega on tihed alt seotud siseenergia mõiste. Selles artiklis käsitleme ideaalse gaasi siseenergiat ja anname selle arvutamise valemid.
Ideaalne gaas
Gaasist kui agregatsiooniseisundist, millel ei ole välismõjul elastsusjõudu ning mille tulemusena ei säili maht ja kuju, teab iga koolilaps. Ideaalse gaasi kontseptsioon jääb paljude jaoks arusaamatuks ja ebaselgeks. Selgitame seda.
Ideaalne gaas on iga gaas, mis vastab kahele järgmisele olulisele tingimusele:
- Selle moodustavatel osakestel pole suurust. Neil on küll suurus, kuid see on nendevaheliste kaugustega võrreldes nii väike, et seda võib kõigis matemaatilistes arvutustes ignoreerida.
- Osakesed ei suhtle üksteisega van der Waalsi jõudude või jõudude abilmuu loodus. Tegelikult on selline vastastikmõju kõigis reaalsetes gaasides olemas, kuid selle energia on kineetiliste osakeste keskmise energiaga võrreldes tühine.
Kirjeldatud tingimusi täidavad peaaegu kõik reaalsed gaasid, mille temperatuur on üle 300 K ja rõhud ei ületa ühte atmosfääri. Liiga kõrge rõhu ja madala temperatuuri korral jälgib gaaside kõrvalekallet ideaalsest käitumisest. Sel juhul räägitakse tõelistest gaasidest. Neid kirjeldab van der Waalsi võrrand.
Ideaalse gaasi siseenergia kontseptsioon
Definitsiooni kohaselt on süsteemi siseenergia selles süsteemis sisalduvate kineetilise ja potentsiaalse energia summa. Kui seda kontseptsiooni rakendada ideaalse gaasi puhul, tuleks potentsiaalne komponent ära visata. Tõepoolest, kuna ideaalse gaasi osakesed ei interakteeru üksteisega, võib neid pidada absoluutses vaakumis vab alt liikuvateks. Uuritavast süsteemist ühe osakese eraldamiseks ei ole vaja teha tööd sisemiste vastasmõju jõudude vastu, kuna neid jõude ei eksisteeri.
Seega langeb ideaalse gaasi siseenergia alati kokku selle kineetilise energiaga. Viimase omakorda määrab üheselt nii süsteemi osakeste molaarmass, nende arv kui ka translatsiooni- ja pöörlemisliikumise keskmine kiirus. Liikumise kiirus sõltub temperatuurist. Temperatuuri tõus toob kaasa siseenergia tõusu ja vastupidi.
Valem jaokssisemine energia
Tähistage ideaalse gaasisüsteemi siseenergiat tähega U. Termodünaamika järgi defineeritakse seda kui erinevust süsteemi entalpia H ning rõhu ja ruumala korrutise vahel, see tähendab:
U=H - pV.
Eelmises lõigus saime teada, et U väärtus vastab kogu gaasiosakeste kineetilisele energiale Ek:
U=Ek.
Statistilisest mehaanikast järeldub ideaalse gaasi molekulaarkineetilise teooria (MKT) raames, et ühe osakese keskmine kineetiline energia Ek1 võrdub järgmine väärtus:
Ek1=z/2kBT.
Siin kB ja T - Boltzmanni konstant ja temperatuur, z - vabadusastmete arv. Süsteemi kogu kineetilise energia Ek saab, korrutades Ek1 süsteemis olevate osakeste arvuga N:
Ek=NEk1=z/2NkBT.
Seega oleme saanud ideaalse gaasi siseenergia valemi, mis on kirjutatud üldkujul absoluutse temperatuuri ja osakeste arvu järgi suletud süsteemis:
U=z/2NkBT.
Monatoomiline ja polüatomiline gaas
Artikli eelmises lõigus kirjutatud U valem on selle praktilise kasutamise jaoks ebamugav, kuna osakeste N arvu on raske määrata. Kui aga võtta arvesse aine koguse n määratlust, saab selle avaldise mugavamal kujul ümber kirjutada:
n=N/NA; R=NAkB=8, 314 J/(molK);
U=z/2nR T.
Vabadusastmete arv z sõltub gaasi moodustavate osakeste geomeetriast. Seega üheaatomilise gaasi puhul z=3, kuna aatom saab iseseisv alt liikuda ainult kolmes ruumisuunas. Kui gaas on kaheaatomiline, siis z=5, kuna kolmele translatsioonilisele vabadusastmele lisandub veel kaks pöörlemisvabadusastet. Lõpuks, mis tahes muu polüaatomilise gaasi puhul z=6 (3 translatsiooni- ja 3 pöörlemisvabadusastet). Seda silmas pidades võime järgmisel kujul kirjutada ühe-, kahe- ja mitmeaatomilise ideaalse gaasi siseenergia valemid:
U1=3/2nRT;
U2=5/2nRT;
U≧3=3nRT.
Siseenergia määramise ülesande näide
100-liitrine silinder sisaldab puhast vesinikku rõhul 3 atmosfääri. Eeldades, et vesinik on antud tingimustes ideaalne gaas, on vaja kindlaks määrata selle siseenergia.

Eespool toodud U valemid sisaldavad aine kogust ja gaasi temperatuuri. Probleemi olukorras ei räägita nendest kogustest absoluutselt mitte midagi. Probleemi lahendamiseks on vaja meelde tuletada universaalset Clapeyron-Mendelejevi võrrandit. Sellel on joonisel näidatud välimus.
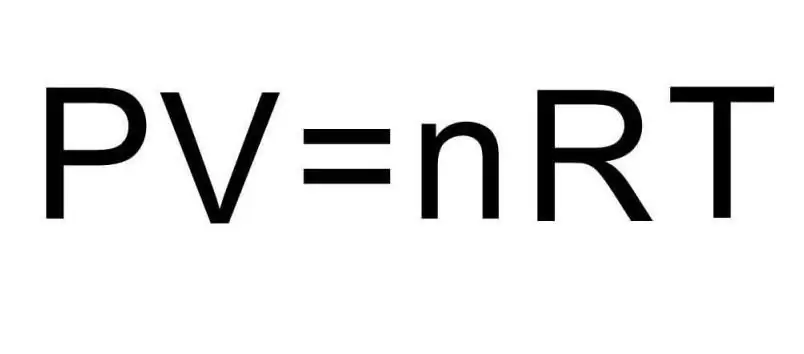
Kuna vesinik H2 on kaheaatomiline molekul, on siseenergia valem järgmine:
UH2=5/2nRT.
Mõlema avaldise võrdlemisel jõuame ülesande lahendamise lõpliku valemini:
UH2=5/2PV.
Jääb üle rõhu ja ruumala ühikute teisendamine tingimusest SI ühikute süsteemi, asendada vastavad väärtused valemis UH2 ja saada vastus: UH2 ≈ 76 kJ.






