Adiabaatiline üleminek kahe oleku vahel gaasides ei kuulu isoprotsesside hulka, kuid sellel on oluline roll mitte ainult erinevates tehnoloogilistes protsessides, vaid ka looduses. Selles artiklis vaatleme, mis see protsess on, ja anname ka ideaalse gaasi adiabaatilised võrrandid.
Ideaalne gaas lühid alt
Ideaalne gaas on gaas, mille osakeste vahel puudub vastastikmõju ja nende suurus on võrdne nulliga. Looduses pole muidugi sada protsenti ideaalseid gaase, kuna need kõik koosnevad molekulidest ja suurusega aatomitest, mis suhtlevad alati üksteisega vähem alt van der Waalsi jõudude abil. Sellegipoolest teostatakse kirjeldatud mudel sageli piisava täpsusega, et lahendada praktilisi probleeme paljude reaalsete gaaside puhul.
Ideaalse gaasi põhivõrrand on Clapeyroni-Mendelejevi seadus. See on kirjutatud järgmisel kujul:
PV=nRT.
See võrrand loob toote vahel otsese proportsionaalsuserõhk P mahul V ja aine kogus n absoluuttemperatuuril T. R väärtus on gaasikonstant, mis mängib proportsionaalsusteguri rolli.
Mis on adiabaatiline protsess?
Adiabaatiline protsess on üleminek gaasisüsteemi olekute vahel, kus energiavahetus keskkonnaga puudub. Sel juhul muutuvad süsteemi kõik kolm termodünaamilist karakteristikku (P, V, T) ja aine n kogus jääb muutumatuks.
Eristage adiabaatilist paisumist ja kokkutõmbumist. Mõlemad protsessid toimuvad ainult tänu süsteemi sisemisele energiale. Nii et laienemise tulemusena langeb rõhk ja eriti temperatuur süsteemis järsult. Seevastu adiabaatiline kokkusurumine toob kaasa positiivse temperatuuri ja rõhu hüppe.
Et vältida soojusvahetust keskkonna ja süsteemi vahel, peavad viimasel olema soojusisolatsiooniga seinad. Lisaks vähendab protsessiaja lühendamine oluliselt soojusvoogu süsteemi ja se alt välja.
Poissoni võrrandid adiabaatilise protsessi jaoks

Termodünaamika esimene seadus on kirjutatud järgmiselt:
Q=ΔU + A.
Teisisõnu, süsteemile edastatud soojust Q kasutatakse süsteemi töö A teostamiseks ja selle siseenergia ΔU suurendamiseks. Adiabaatilise võrrandi kirjutamiseks tuleks panna Q=0, mis vastab uuritava protsessi definitsioonile. Saame:
ΔU=-A.
Isohoorigaprotsess ideaalses gaasis läheb kogu soojus sisemise energia suurendamiseks. See fakt võimaldab meil kirjutada võrdsuse:
ΔU=CVΔT.
Kus CV on isohooriline soojusmahtuvus. Töö A omakorda arvutatakse järgmiselt:
A=PdV.
Kui dV on väike helitugevuse muutus.
Lisaks Clapeyroni-Mendelejevi võrrandile kehtib ideaalse gaasi kohta järgmine võrrand:
CP- CV=R.
Kus CP on isobaarne soojusmahtuvus, mis on alati suurem kui isohooriline, kuna see võtab arvesse paisumisest tingitud gaasikadusid.
Analüüsides ül altoodud võrrandeid ning integreerides temperatuuri ja ruumala, saame järgmise adiabaatilise võrrandi:
TVγ-1=konst.
Siin γ on adiabaatiline indeks. See võrdub isobaari soojusmahtuvuse ja isohoorilise soojusmahtuvuse suhtega. Seda võrdsust nimetatakse adiabaatilise protsessi Poissoni võrrandiks. Rakendades Clapeyroni-Mendelejevi seadust, saate kirjutada veel kaks sarnast avaldist, ainult parameetrite P-T ja P-V kaudu:
TPγ/(γ-1)=const;
PVγ=konst.
Adiabaatilise graafiku saab esitada erinevatel telgedel. Allpool on see näidatud P-V telgedena.
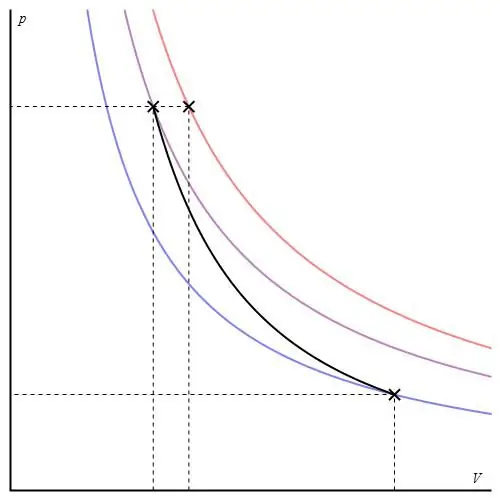
Värvilised jooned graafikul vastavad isotermidele, must kõver on adiabaat. Nagu näha, käitub adiabaat teravam alt kui ükski isoterm. Seda asjaolu on lihtne seletada: isotermi puhul muutub rõhk tagasivõrdeline mahuga, kuid isobaadi puhul muutub rõhk kiiremini, kuna eksponent on γ>1 mis tahes gaasisüsteemi puhul.
Näidisprobleem
Looduses, mägistel aladel, kui õhumass liigub nõlvast ülespoole, selle rõhk langeb, selle maht suureneb ja jahtub. See adiabaatiline protsess alandab kastepunkti ja tekitab vedelaid ja tahkeid sademeid.

Pakutakse lahendada järgmine probleem: õhumassi tõstmise käigus piki mäe nõlva langes rõhk 30% võrreldes rõhuga jalamil. Kui suur oleks selle temperatuur, kui jalalaba juures oleks 25 oC?
Probleemi lahendamiseks kasutage järgmist adiabaatilist võrrandit:
TPγ/(γ-1)=konst.
Parem on see kirjutada järgmisel kujul:
T2/T1=(P2/P 1)(γ-1)/γ.
Kui P1 võtta 1 atmosfäärina, siis P2 võrdub 0,7 atmosfääriga. Õhu puhul on adiabaatiline indeks 1,4, kuna seda võib pidada kaheaatomiliseks ideaalgaasiks. Temperatuuri väärtus T1 on 298,15 K. Asendades kõik need arvud ül altoodud avaldisesse, saame T2=269,26 K, mis vastab - 3, 9 oC.






